شیمی آلی آرسنیک
شیمی آلی آرسنیکی (Organoarsenic chemistry) عبارت است از شیمی ترکیبات دارای پیوند شیمیایی میان آرسنیک و کربن. برخی ترکیبهای آلی آرسنیکی را که اُرگانوآرسنیکال مینامند به صورت صنعتی تولید میشوند و به عنوان حشرهکش، علفکش و قارچکش کاربرد دارند. البته در کل به دلیل ملاحظات محیط زیستی و آسیب به سلامت انسان، تولید این محصولات رو به کاهش است. ترکیب مادر در این محصولات، آرسین و آرسنیک اسید است. برخلاف مسموم بودن این مواد، زیستمولکول ترکیبهای آلی آرسنیکی به خوبی شناخته شدهاست.
پیشینه[ویرایش]
با وجود اینکه بحث شیمی آلی آرسنیکی از اهمیت کمتری برخوردار است اما میتوان گفت این مبحث به نوعی تاریخ علم شیمی است. قدیمیترین ترکیب آلی آرسنیکی کاکودیل است که در سال ۱۷۶۰ گزارش آن منتشر شد و گاهی آن را نخستین ترکیب آلی فلزی مینامند. ترکیب سالوارسان نخستین مادهٔ شیمیایی دارویی است که سازنده اش، پل الریخ برای ساخت آن جایزهٔ نوبل دریافت کرد. بسیاری از ترکیبهای آلی آرسنیکی قبلاً به عنوان آنتیبیوتیک مصرف میشدند یا دیگر کاربردهای پزشکی داشتند.[۱]
شیمی و ساخت[ویرایش]
ترکیبهای آرسنیک معمولاً عدد اکسایش ۳ یا ۵ دارند که در پیوند با هالیدها با فرض X = F, Cl, Br, I به شکل AsX3 و AsF5 دیده میشوند. از این رو ترکیبهای آلی آرسنیک هم معمولاً با همین دو عدد اکسایش دیده میشوند.[۲]
در جنگ[ویرایش]
ترکیبهای آلی آرسنیکی بویژه آنهایی که پیوند As-Cl دارند در جریان جنگ جهانی اول به عنوان جنگافزار شیمیایی کاربرد داشتند. نمونههایی که چندان شناخته شده نیستند عبارتند از: لوئیزیت (کلرووینیل-۲-آرسنیک دیکلرید)، کلارک ۱ (دیفنیلکلرآرسین) و فنیلدیکلروآرسین.
در طبیعت[ویرایش]
از آنجایی که آرسنیک برای بیشتر اندامهای زیستی در طبیعت سمی بهشمار میرود، در جاهایی که غلظت آن بیشتر است برخی فعالیتهای سم زدایی روی آن صورت میگیرد. آرسنیک معدنی و ترکیبهایش به محض ورود به زنجیره غذایی از طریق متیلدار کردن به موادی که کمتر سمی اند تبدیل میشود.[۳] ترکیبهای آلی آرسنیکی از متیلدار کردن زیستی ترکیبهای معدنی آرسنیک بدست میآیند،[۴] این کار توسط آنزیمهای مرتبط با ویتامین ب۱۲ انجام میشود.[۵] برای مثال نوعی کپک در حضور آرسنیک معدنی، مقدار زیادی تریمتیلآرسین تولید میکند. ترکیبهای آلی آرسنوبتائین و بتائین در برخی خوراکهای دریایی مانند ماهی و جلبک و همچنین در غلظت زیاد در قارچ یافت میشود. هر فرد در طول عمرش بهطور متوسط ۱۰ تا ۵۰ میکروگرم در روز، آرسنیک مصرف میکند. اگر افراد به ماهی و قارچ علاقه داشته باشند مصرف ۱۰۰۰ میکروگرم در روز دور از انتظار نیست. خوردن ماهی خطر کمتری دارد چون آرسنیک موجود در آن چندان سمی نیست.[۶] آرسنوبتائین نخستین بار در شاهمیگوی تیغی غربی یافت شد.[۷][۸]
کربوهیدراتهای آرسنیکی که به شکرهای آرسنیکی هم معروف است در جلبک دریایی بیشتر دیده میشود. چربیهای آرسنیکی هم شناخته شدهاند.[۹] با اینکه آرسنیک و ترکیباتش برای انسان سمی است، اما نخستین آنتیبیوتیک دست ساز، آرسفنامین یک ترکیب آرسنیکی است که البته مدتها است از آن استفاده نمیشود.
برخی ترکیبهای معروف[ویرایش]
| آلی آرسنیکی | R | جرم مولی | شماره ثبت سیایاس | ویژگیها | |
| 10,10'-oxybis-10H-Phenoxarsine |  |
۵۰۲٫۲۳۱۸ | ۵۸-۳۶-۶ | ||
| تریفنیلآرسین | گروه فنیل |  |
۳۰۶٫۲۳ | ۶۰۳-۳۲-۷ | دمای ذوب ۵۸–۶۱ °C |
| فنیلدیکلروآرسین | گروه فنیل، کلر | 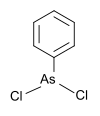 |
۲۲۲٫۹۳ | ۶۹۶-۲۸-۶ | |
| ۴-هیدروکسی-۳-نیتروبنزنآرسونئیک اسید | 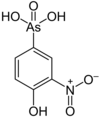 |
۲۶۳٫۰۴ | ۱۲۱-۱۹-۷ | ||
| Arsenobetaine | 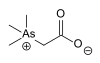 |
۶۴۴۳۶-۱۳-۱ | |||
| ترکیبهای آلی آرسنیکی شاخص[۱۰] | |||||
منابع[ویرایش]
- ↑ Singh, R. Synthetic Drugs. Mittal Publications (2002).ISBN 817099831X
- ↑ Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf "Arsenic and Arsenic Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, VCH-Wiley, 2008, Weinheim.
- ↑ Reimer, K. J.; Koch, I.; Cullen, W. R. (2010). "Organoarsenicals. Distribution and transformation in the environment". Metal ions in life sciences. Cambridge: RSC publishing. 7: 165–229. doi:10.1039/9781849730822-00165. ISBN 978-1-84755-177-1. PMID 20877808.
- ↑ Dopp, E.; Kligerman, A. D.; Diaz-Bone, R. A. (2010). "Organoarsenicals. Uptake, metabolism and toxicity". Metal ions in life sciences. Cambridge: RSC publishing. 7: 231–265. doi:10.1039/BK9781847551771-00231. ISBN 978-1-84755-177-1. PMID 20877809.
- ↑ Toshikazu Kaise; Mitsuo Ogura; Takao Nozaki; Kazuhisa Saitoh; Teruaki Sakurai; Chiyo Matsubara; Chuichi Watanabe; Ken'ichi Hanaoka (1998). "Biomethylation of Arsenic in an Arsenic-rich Freshwater Environment". Applied Organometallic Chemistry. 11: 297–304. doi:10.1002/(SICI)1099-0739(199704)11:4<297::AID-AOC584>3.0.CO;2-0.
- ↑ Cullen, William R.; Reimer, Kenneth J. (1989). "Arsenic speciation in the environment". Chemical Reviews. 89 (4): 713–764. doi:10.1021/cr00094a002.
- ↑ Francesconi, Kevin A.; Edmonds, John S. (1998). "Arsenic Species in Marine Samples" (PDF). Croatian Chemica Acta. 71 (2): 343–359. Archived from the original (PDF) on 9 March 2008. Retrieved 27 February 2017.
- ↑ John S. Edmonds, Kevin A. Francesconi, Jack R. Cannon, Colin L. Raston, Brian W. Skelton and Allan H. White (1977). "Isolation, crystal structure and synthesis of arsenobetaine, the arsenical constituent of the western rock lobster panulirus longipes cygnus George". Tetrahedron Letters. 18 (18): 1543–1546. doi:10.1016/S0040-4039(01)93098-9.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Alice Rumpler; John S. Edmonds; Mariko Katsu; Kenneth B. Jensen; Walter Goessler; Georg Raber; Helga Gunnlaugsdottir; Kevin A. Francesconi (2008). "Arsenic-Containing Long-Chain Fatty Acids in Cod-Liver Oil: A Result of Biosynthetic Infidelity?". Angew. Chem. Int. Ed. 47: 2665–2667. doi:10.1002/anie.200705405. PMID 18306198.
- ↑ http://www.sigmaaldrich.com
