اکسایش اوپناور
| اکسایش اوپناور | |
|---|---|
| نامگذاری شده پس از | روپرت ویکتور اوپناور |
| نوع واکنش | اکسایش و کاهش آلی |
| شناسهها | |
| در درگاه شیمی آلی | oppenauer-oxidation |
| RSC ontology ID | RXNO:0000047 |
اکسایش اوپناور(به انگلیسی: Oppenauer oxidation)، که به نام روپرت ویکتور اوپناور نامگذاری شده است،[۱] یک روش ملایم برای اکسایش انتخابی الکلهای نوع دوم به کتونها است.

این واکنش برعکس کاهش میروین–پوندورف–ورلی است.[۲] الکل با آلومینیوم ایزوپروپوکسید در استون اضافی اکسید می شود. به این ترتیب تعادل به سمت محصول تغییر می کند.
اکسایش برای الکل های نوع دوم بسیار انتخابی است و سایر گروههای عاملی حساس مانند آمینها و سولفیدها را اکسید نمی کند.[۳] اگرچه الکلهای نوع اول را می توان تحت شرایط اوپناور اکسید کرد، الکلهای نوع اول به ندرت با این روش اکسید می شوند و دلیل آن تراکم آلدولی رقابتی محصولات آلدهیدی است. اکسایش اوپناور هنوز برای اکسایش بسترهای حساس به اسید استفاده می شود. این روش تا حد زیادی با روش های اکسایش مبتنی بر کروماتها (مانند پیریدینیوم کلروکرومات) یا دیمتیل سولفوکسید (مثلاً اکسایش سوورن) یا اکسایش دس–مارتین جایگزین شده است و دلیل آن استفاده از واکنشگرهای نسبتاً ملایم و غیر سمی (مثلاً واکنش در مخلوط استون/بنزن) در این واکنشها است. اکسایش اوپناور معمولاً در فرآیندهای مختلف صنعتی مانند سنتز استروئیدها، هورمونها، آلکالوئیدها، ترپنها و دیگر ترکیبات استفاده می شود.
سازوکار[ویرایش]
در مرحله اول این سازوکار، الکل (۱) با آلومینیوم کوئوردینه می شود و یک کمپلکس (۳) تشکیل می دهد، سپس در مرحله دوم توسط یک یون آلکوکسید (۴) پروتونزدایی می شود و یک آلکوکسید حد واسط تولید می کند (۵). در مرحله سوم، هم استون اکسیدان (۷) و هم الکل بستر به آلومینیوم متصل می شوند. استون با آلومینیوم کوئوردینه می شود که آن را برای انتقال هیدرید از آلکوکسید فعال می کند. هیدریدِ کاتالیز شده با آلومینیوم، از کربن آلفای الکل به کربنِ کربونیلِ استون، طی یک حالت حالت گذار شش عضوی جابجا می شود (۸). کتون مورد نظر (۹) پس از انتقال هیدرید تشکیل می شود.[۴]
مزایا[ویرایش]
یکی از مزایای اکسایش اوپناور استفاده از واکنشگرهای نسبتاً ارزان و غیر سمی است. شرایط واکنش ملایم و آرام است زیرا بسترها معمولاً در مخلوطهای استون/بنزن گرم میشوند. یکی دیگر از مزایای اکسایش اوپناور که آن را بر سایر روش های اکسایش مانند پیریدینیوم کلروکرومات (PCC) و پریدینان دس–مارتین منحصر به فرد می کند این است که الکل های نوع دوم بسیار سریعتر از الکل های نوع اول اکسید می شوند، بنابراین می توان به نوعی شیمی گزینی دست یافت. علاوه بر این، هیچ اکسایش بیش از حدی بر روی آلدهیدها که منجر به تبدیل آنها به کربوکسیلیک اسید شوند، صورت نمی گیرد. این بر خلاف روش های اکسایش دیگر مانند اکسایش جونز است.[۵]
اصلاحات[ویرایش]
واکنش وتشتاین-اوپناور[ویرایش]
در واکنش وتشتاین-اوپناور که توسط وتشتاین در سال ۱۹۴۵ کشف شد، استروئیدهای Δ۵-۳β-هیدروکسی با بنزوکینون به عنوان گیرنده هیدروژن، به Δ۴٬۶-۳-کتواستروئید، اکسید می شوند. این واکنش از این جهت مفید است که تهیه یک مرحله ای Δ۴٬۶-۳-کتواستروئیدها را امکانپذیر می سازد.[۶]
اصلاح وودوارد[ویرایش]
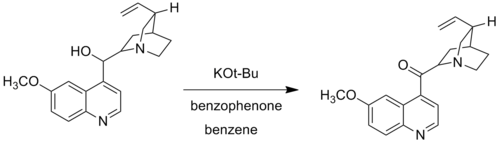
در اصلاح وودوارد، وودوارد پتاسیم ترت-بوتواکسید را جایگزین آلومینیوم آلکوکسید کرد. اصلاح وودوارد که اکسایش اوپناور-وودوارد نیز نامیده می شود، زمانی استفاده می شود که گروههای الکلی خاصی تحت شرایط استاندارد واکنش اوپناور اکسید نمی شوند. به عنوان مثال، وودوارد از پتاسیم ترت-بوتواکسید و بنزوفنون برای اکسایش کینین به کینینون استفاده کرد، زیرا سیستم کاتالیزوری آلومینیوم سنتی به دلیل کمپلکسی که از کوئوردینه شدن نیتروژنِ باز لوئیسی با مرکز آلومینیوم تشکیل شده بود، نتوانست کینین را اکسید کند.[۷]
سایر اصلاحات[ویرایش]
چندین کاتالیزور آلومینیوم آلکوکسید اصلاح شده نیز گزارش شده است. به عنوان مثال، یک کاتالیزور آلومینیوم بسیار فعال توسط ماروکا و همکارانش گزارش شد که در اکسایش کاروِال به کاروون (عضو یک خانواده از مواد شیمیایی به نام ترپنوئیدها) با بازده عالی (۹۴٪) استفاده شده است.[۸]
در اصلاح دیگری [۹] کاتالیزور تریمتیلآلومینیوم و آلدهید ۳-نیتروبنزآلدهید به عنوان اکسیدان استفاده می شود، به عنوان مثال، در اکسایش ایزوبورنئول به کافور.
کاربردهای سنتزی[ویرایش]
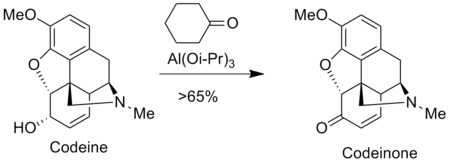
اکسایش اوپناور برای تهیه داروهای ضد درد در صنعت داروسازی مانند مورفین و کدئین استفاده می شود. به عنوان مثال، کدئینون با اکسایش اوپناور کدئین تهیه می شود.[۱۰]
همچنین این واکنش برای سنتز هورمونها استفاده می شود. پروژسترون با اکسایش اوپناور پرگننولون تهیه می شود.
نسخه ای از اکسایش اوپناور با تغغیراتی جزئی برای سنتز مشتقات استروئیدی استفاده می شود. به عنوان مثال، یک نسخه کاتالیزوری کارآمد از اکسایش اوپناور که از یک کاتالیزور روتنیم استفاده می کند برای اکسایش استروئیدهای ۳β-هیدروکسی ۵-غیراشباع به مشتق ۴-ان-۳-اون مربوطه توسعه یافته است.[۱۱]
اکسایش اوپناور در سنتز لاکتونها از ۴٬۱ و ۵٬۱ دیالها نیز استفاده می شود.[۱۲]
واکنشهای جانبی[ویرایش]
واکنش جانبی متداول در اکسایش اوپناور، تراکم آلدولی کاتالیز شده با باز محصول آلدهیدی است، که دارای هیدروژنهای α بوده و منجر به تشکیل β-هیدروکسی آلدهیدها یا ß،α-آلدهیدهای غیراشباع می شوند.[۱۳]
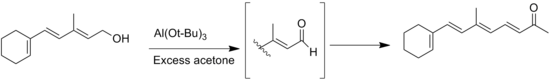
واکنش جانبی دیگر واکنش تیشچنکوی محصولات آلدهیدی بدون هیدروژن α است، اما با استفاده از حلالهای انیدروز میتوان از آن جلوگیری کرد.[۱۴] یکی دیگر از واکنشهای جانبی عمومی، مهاجرت پیوند دوگانه در طول اکسایش بسترهای الکل اللی است.[۱۵]
![اکسایش اوپناور یک مشتق استروئیدی. [۱۶]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/36/Wiki-oppenaure-mxa2.tif/lossy-page1-350px-Wiki-oppenaure-mxa2.tif.jpg)
همچنین ببینید[ویرایش]
- اکسایش الکل
- کلروکرومات پیریدینیم
- اکسایش جونز
- اکسایش فیتزنر–موفات
- اکسایش پاریخ–دورینگ
- اکسایش آلبرایت–گلدمن
- اکسایش سوورن
- اکسایش کوری–کیم
- اکسایش پریدینان دس–مارتین
- اکسایش لی (اکسایش TPAP)
- اکسایش TEMPO
منابع[ویرایش]
- ↑ Oppenauer, R. V. (1937). "Eine Methode der Dehydrierung von Sekundären Alkoholen zu Ketonen. I. Zur Herstellung von Sterinketonen und Sexualhormonen" [Dehydration of secondary alcohols to ketones. I. Preparation of sterol ketones and sex hormones]. Recl. Trav. Chim. Pays-Bas (به آلمانی). 56 (2): 137–144. doi:10.1002/recl.19370560206.
- ↑ Wilds, A. L. (1944). "Reduction with Aluminum Alkoxides (The Meerwein-Ponndorf-Verley Reduction)". Org. React. 2 (5): 178–223. doi:10.1002/0471264180.or002.05.
- ↑ Otvos, L.; Gruber, L.; Meisel-Agoston, J. (1965). "The Meerwein-Ponndorf-Verley-Oppenauer. Investigation of the reaction mechanism with radiocarbon. Racemization of secondary alcohols". Acta Chim. Acad. Sci. Hung. 43: 149–153.
- ↑ Corey, E.J; Nicolaou, K.C. (2005). Strategic Applications of Named Reactions in Organic Synthesis. Elsevier. ISBN 978-7-03-019190-8.
- ↑ Corey, E.J; Nicolaou, K.C. (2005). Strategic Applications of Named Reactions in Organic Synthesis. Elsevier. ISBN 978-7-03-019190-8.
- ↑ Mandell, L. (1955). "The Mechanism of the Wettstein-Oppenauer Oxidation". J. Am. Chem. Soc. 78 (13): 3199–3201. doi:10.1021/ja01594a061.
- ↑ Woodward, R. B.; Wendler, N. L.; Brutschy, F. J. (1945). "Quininone1". J. Am. Chem. Soc. 67 (9): 1425. doi:10.1021/ja01225a001.
- ↑ Ooi, T; Otsuka, H; Miura, T; Ichikawa, H; Maruoka, K (2002). "Practical Oppenauer (OPP) oxidation of alcohols with a modified aluminum catalyst". Organic Letters. 4 (16): 2669–72. doi:10.1021/ol020094c. PMID 12153205.
- ↑ Graves, C. R.; Zeng, B. S.; Nguyen, S. T. (2006). "Efficient and Selective Al-Catalyzed Alcohol Oxidation via Oppenauer Chemistry". Journal of the American Chemical Society. 128 (39): 12596–7. doi:10.1021/ja063842s. PMID 17002323.
- ↑ Stéphane Caron; Robert W. Dugger; Sally Gut Ruggeri; John A. Ragan; David H. Brown Ripin (2006). "Large-Scale Oxidations in the Pharmaceutical Industry". Chem. Rev. 106 (7): 2943–89. doi:10.1021/cr040679f. PMID 16836305.
- ↑ Almeida, Maria L.S.; Kočovský, Paval; Bäckvall, Jan-E. (1996). "Ruthenium-Catalyzed Oppenauer-Type Oxidation of 3β-Hydroxy Steroids. A Highly Efficient Entry into the Steroidal Hormones with 4-En-3-one Functionality". J. Org. Chem. 61 (19): 6587–6590. doi:10.1021/jo960361q. PMID 11667525.
- ↑ Eignerova, L.; Kasal, A. (1976). "Intramolecular hydride shift in Oppenauer oxidation of some dihydroxy steroids". ChemPlusChem. 41 (4): 1056–1065. doi:10.1135/cccc19761056.
- ↑ Milas, N. A.; Grossi, F. X.; Penner, S. E.; Kahn, S. (1948). "The Synthesis of 1-[cyclohexen-1'-yl]-3-Methyl-1,3,5-Octatrien-7-One (C15Ketone)1". Journal of the American Chemical Society. 70 (3): 1292. doi:10.1021/ja01183a522.
- ↑ Corey, E.J; Nicolaou, K.C. (2005). Strategic Applications of Named Reactions in Organic Synthesis. Elsevier. ISBN 978-7-03-019190-8.
- ↑ Reich, R.; Keana, J. F. W. (1972). "Oppenauer Oxidations Using 1-Methyl-4-Piperidone as the Hydride Acceptor". Synthetic Communications. 2 (5): 323. doi:10.1080/00397917208061988.
- ↑ Reich, Richard; Keana, John F. W. (1972). "Oppenauer Oxidations Using 1-Methyl-4-Piperidone as the Hydride Acceptor". Synth. Commun. 2 (5): 323–325. doi:10.1080/00397917208061988.