انبساط حلقه بوخنر
| انبساط حلقه بوخنر | |
|---|---|
| نامگذاری شده پس از | ادوارد بوخنر |
| نوع واکنش | واکنشهای بازآرایی |
انبساط حلقه بوخنر (به انگلیسی: Buchner ring expansion) یک واکنش تشکیل پیوند کربن-کربن دومرحلهای است که برای تشکیل حلقههای ۷ عضوی استفاده میشود. این واکنش برای اولین بار توسط ادوارد بوخنر و تئودور کورتیوس در سال ۱۸۸۵ مورد استفاده قرار گرفت.[۱][۲] آنها با کمک حرارت دادن اتیل دیآزواستات موفق به تولید کاربن در محیط واکنش شدند و سپس با افزودن آن به بنزن، سرانجام موجب تولید یک مولکول حلقوی ۷ عضوی یعنی یک سیکلوهپتاتریان شدند. در طول سالهای گذشته تغییرات مختلفی در دستورالعمل اولیه این روش ارائه شده است بهطوری که پیشرفتها در شیمی آلی-فلزی و توسعه کاتالیزورها موجب شد که مشخص شود کاتالیزوردیرودیم توانایی تولید یک ایزومر مشخص از محصول سیکلوهپتاتریان را دارد.

مکانیزم واکنش[ویرایش]
بهطور سنتی فرایند انجام واکنش به این صورت بهپیش میرود که در مرحله اول، اتیل دیآزواستات منجر به تولید یک کاربن میشود که این کاربن میتواند در ادامه در واکنش با حلقه آروماتیک، موجب تولید یک حلقه سیکلوپروپان شود. مرحله دوم، جایی است که انبساط حلقه رخ میدهد و طی آن حلقه سیکلوپروپان از طریق انجام یک از طریق یک واکنش الکتروسیکلی باز شده و حلقه ۷ عضوی (یک سیکلوهپتاتریاِن) تشکیل میشود. با این حال در روشهای مدرن به جای اتیل دیآزواستات میتوان از دیگر گونههای دارای توانایی تولید کاربن، مانند دیآزومتان استفاده کرد.

کاربردها[ویرایش]
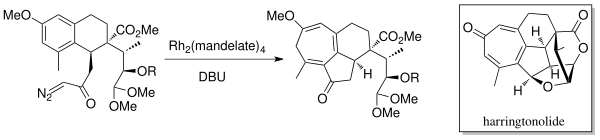
اهمیت این واکنش به صورت آشکاری در شیمی سنتزی بهخصوص در سنتز ترکیبات زیستی قابل مشاهده است. به عنوان یکی از کاربردهای مهم این واکنش، استفن ماتین و لام چن در سال ۱۹۸۱ موفق به تولید مشتقی از مولکول پنیسیلین شدند.[۳]
محدودیتها[ویرایش]
به عنوان مهمترین محدودیت واکنش میتوان به گونه کاربن تولید شده طی در حین انجام اشاره کرد. با توجه به واکنشپذیری بالای کاربن و ناپایداری آن، انتخاب حلال بسیار اهمیت دارد و باید با دقت انجام شود. از طرف دیگر گونه کاربن پتانسیل بالایی برای انجام واکنش جایگیری در پیوند کربن-هیدروژن دارد و این موضوع بهخصوص زمانی که از حلالی مانند دیکلرومتان استفاده شود رخ میدهد و گونه کاربن تولید شده با پیوند کربن-هیدروژن موجود در حلال واکنش میدهد.[۴]

کنترل جهتگزینی واکنش کاربن، مورد دیگری است که نیازمند توجه است. بهطوری که کاربن میتواند منجر به تولید ایزومرهای مختلفی از مولکول سیکلوهپتاتریان شود. با استفاده از کاتالیزور رودیم و استفاده از دمای اتاق میتوان به ایزومر غیرمزدوجی از محصول (Non-conjugated) دست یافت.[۵]

جستارهای وابسته[ویرایش]
منابع[ویرایش]
- ↑ Buchner, E.; Curtius, T. (1885), "Ueber die Einwirkung von Diazoessigather auf aromatisch Kohlenwasserstoffe", Ber. Dtsch. Chem. Ges., 18 (2): 2377–2379, doi:10.1002/cber.188501802119
- ↑ Buchner, E.; Curtius, T. (1885), "Synthesis of beta-Keto esters from aldehydes and diazoacetic acid.", Ber. Dtsch. Chem. Ges., 18 (2): 2371–2377, doi:10.1002/cber.188501802118
- ↑ Matlin, S. A.; Chan, L. (1981), "New spiro derivatives of penicillin", Tetrahedron Letters, 22 (40): 4025–4028, doi:10.1016/S0040-4039(01)82055-4
- ↑ Lovely, C. J.; Browning, R. G.; Badarinaray, V.; Rasika Dias, H. V. (2005), "A silver-catalyzed Buchner reaction", Tetrahedron Letters, 46 (14): 2453–2455, doi:10.1016/j.tetlet.2005.02.052
- ↑ Doering, W. v. E.; Laber, G.; Vonderwahl, R.; Chamberlain, N. F.; Williams, R. B. (1956), "The structure of the Buchner Acids", J. Am. Chem. Soc., 78 (20): 5448, doi:10.1021/ja01601a080
- مشارکتکنندگان ویکیپدیا. «Buchner ring expansion». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲۰ خرداد ۱۳۹۹.
